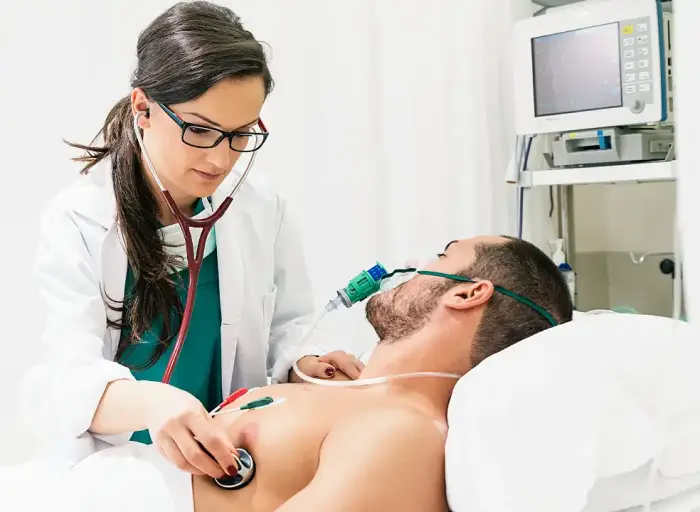
¿Por qué se ha pausado temporalmente la administración de la vacuna de AstraZeneca?
En España se ha decidido suspender la aplicación de la vacuna AstraZeneca durante las próximas dos semanas tras notificar casos de trombosis venosa cerebral, poco frecuentes en la población general. Mientras la Agencia Europea del Medicamento investiga si hay alguna relación entre la vacuna y estas notificaciones, en Chile ya está aprobado su uso por el Instituto de Salud Pública.
España decidió ayer lunes pausar durante quince días la administración de la vacuna contra la covid-19 de AstraZeneca. Esta suspensión temporal, según explicó el Ministerio de Sanidad en un comunicado, se produce tras conocer varias notificaciones de casos en Europa –una de ellas en España– de un tipo de trombo muy específico y poco frecuente en la población general: trombosis venosa cerebral.
El 27 de enero se aprobó en Chile la aplicación de esta vacuna por parte del Instituto de Salud Pública (ISP). Sin embargo, se espera que los primeros cargamentos lleguen al país el mes de abril. Indicaron que «actualmente no existe evidencia suficiente para asegurar que los eventos tromboembólicos presentados estén asociados a la administración de la vacuna«.
Casos más bajos en ensayos clínicos de AstraZeneca
La farmacéutica AstraZeneca, por su parte, ha emitido un comunicado en el que afirman que no existen evidencias de que su vacuna aumente el riesgo de embolia pulmonar, trombosis venosa profunda o trombocitopenia “en ningún grupo de edad, género, país o lote en particular” después de revisar los datos de seguridad de las más de 17 millones de personas vacunadas en la Unión Europea y Reino Unido. Estas declaraciones se emitieron después de que un lote concreto (el ABV5300) fuera inmovilizado por una relación no confirmada entre este y los casos de trombosis reportados en Europa.
A fecha de 8 de marzo, “las autoridades europeas reportaron 15 casos de trombosis venosa profunda y 22 de embolia pulmonar entre personas que recibieron la vacuna. Esto es una incidencia mucho menor de la que se espera que ocurra en la población general”, defiende la compañía.
Respecto a esto, AstraZeneca señala que el número de casos de trombosis durante sus ensayos clínicos fue pequeño e incluso más reducido en aquel grupo que recibió el fármaco, en comparación al grupo control que recibió un placebo.
La jefa de la Oficina Médica de AstraZeneca, Ann Taylor, apunta que la naturaleza de esta pandemia ha hecho que incrementemos la atención en los casos individuales: “Vamos más allá de las prácticas habituales de control de seguridad de los medicamentos autorizados a la hora de reportar casos relacionados con las vacunas”.
Artículo adaptado de ¿Por qué se ha pausado temporalmente la administración de la vacuna de AstraZeneca? de Agencia Sinc.